| �����{���w�@��������������@�@ |
| �����{���w�@��������������@�@ |
| �@�@�@�@�@�@�����Q�U�N�@�U�� �Q�X���i���j �@�@�@�@�@�@�@�@�@�@�@�@���F���� |
| �@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@ �i�P�j�@������ �ǂ�ȋ����������Ȍ��q����������W�܂��Ăł��Ă��܂��B������1�̌��q�ɂ͒��S�����q�j������A ���̎���ɂ��������d�q�����݂��Ă��܂��B�d�q�͌��q�j�̎���ɂ���A���܂����R�[�X(�k�j���� ���Ă��܂��B �Ƃ��낪�A����������M����ƁA��������ĂP�P���̌��q�ɂȂ�܂��B���q�����M�����ƁA �����̊k�ƁA�O���̊k�ł͓d�q�������Ă���G�l���M�[���Ⴂ�A�����G�l���M�[�̍������̃G�l���M
���@�Q���̃x�����E���E�}�O�l�V�E���͂ӂ��A�A���J���y�ދ����ɂ͊܂݂܂���B����āA���F������ ����܂���B
�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�i�Q�j�@����������� �������E�����G�^�m�[���E�X�|�C�g�E�A���~�P�[�X�E�����M�E�`���b�J�}���E�K�X�o�[�i�[�E�o�P�c�E�������� �H���E�z�E�_�E�~���E�o���E�J���V�E���E�Y�_���f�i�g���E���E���̑� �@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�i�R�j�@�菇 �@�@�����M�̏�ɃA���~�J�b�v�����A���̒��ɂ��ꂼ��̖�i�����A�������ŗn�����B �A�@�����G�^�m�[�������ʉ����A�������Â����Ă���A�����ĉ��̐F���ώ@����B �@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�i���ɐ��̓������o�P�c�ƔG�ꂼ�������p�ӂ��Ă����B�j �@�@���@�Q�l�@�@�����̔g���i�P�ʂ́Anm[�i�m���[�g��]�E�P�O�����̂P���[�g���j �@�@�@ �@�@�@�@�@�@�@�@�@�@�g���̒����ƃG�l���M�[�̑傫���͔���Ⴕ�܂��B �@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@ 
|
| �@�@�����Q�U�N�@�T�� �Q�T���i���j�@�E�@�U���P���i���j�@�@ �@�@�@�@�@��C���ƕ\�ʒ��́@�u�t���R�b�v�v�̌��� |
| �u�t���R�b�v�v�̎����́A�ǂ����ł����ɂȂ����̂ł͂Ȃ��ł��傤���H�܂������g�ő̌� ���ꂽ���Ƃ����邩������܂���B������ꂽ�R�b�v�ɔڎ��i�����j�łӂ������āA��� �Y���ċt���܂ɂ��āA��𗣂��Ă��������ڂ�Ȃ��Ƃ������̂ł��B �u������̑�C���ʼn��������Ă��ڂ�Ȃ��v�Ƃ������������ŗ�������Ă���������� �Ǝv���܂����A���͂��ꂾ���ł͂Ȃ��̂ł��B����͂��̉��[���������w�ԂƂƂ��ɁA ���̔��W�^�̎��������Ă݂܂��傤�B |
| �@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@ �p�ӂ������ �d���̃v���X�`�b�N�R�b�v�A���ʊ�A�����ǁi���a�̈قȂ���̐���ށj�A�����r�� �ڎ��i�����P�������x�̎��j�A�l�b�g�i�䏊�p�j�A�r�j�[���e�[�v �@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�����i�P�j �ڎ��ɂ���ŁA���낢��ȑ傫���̌��������A����Ő�����ꂽ�R�b�v�ɂӂ��� ���Ď�𗣂��B���͂��ڂ��ł��傤���H |
| �@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�����O�̉�� �܂��A������ꂽ�R�b�v�ɔڎ��łӂ������ċt���܂ɂ��Ă��������ڂ�Ȃ��̂́A�ЂƂ� ��C���ɂ��͂ł��B�C�^���A���g���`�F���[�́A��C���̎����������Ȋw�҂Ƃ��Ă��L���ł� ���A���œ�������������ƁA��C���͐����P�O���������グ��͂����邱�Ƃ��킩��܂��B �R�b�v�̉�������傫�ȗ͂����ɂ������Ă���̂ł��B �������A��C�������ł͐����ł��Ȃ����ۂ�����܂��B���ʂ̓R�b�v�̒��̐�����t�ɂ��āA ���ɋ�C�����Ȃ��Ŏ������܂����A���Ƃ��A�R�b�v�̒��̐����ɂ�����A�R�b�v�� �e�ς̂P�O���̂P�ȉ��̐��ɂ��Ă��Ƃ͋�C����������Ԃŋt���܂ɂ��Ă����͗��ꗎ�����A ���̓R�b�v�ɂ����܂܂ł��B �R�b�v�̒��̋�C�͂قڂP�C���ŁA�R�b�v�̊O�̋C���Ƃ肠���Ă��܂��B�����Ē��ɂ͐��� �����Ă��܂��B����ł��������ڂ�Ȃ��Ƃ����̂́A������x���Ă���̂͑�C�������łȂ� �Ƃ������Ƃ��킩��܂��B ��C���̑��ɉ��̗͂��͂��炢�Ă���̂������ƁA����͊F��������ɂ������Ƃ����鐅�� �\�ʒ����ł��B�����q�̕��q�Ԉ��͂ɂ��A����}��Ƃ��ăR�b�v�Ǝ�����������͂�A ���Ǝ��̊Ԃɂ����݂��Ɉ����������͂������܂��B ���̂悤�Ɍő̂ƌő́A�܂��t�̂ƌő́i���̑g�ݍ��킹������܂��j�̊Ԃł͂��炭�͂��E�� �����Ƃ����A���ɕ\�ʐρi�E�ʁj������������悤�ɂ͂��炭�͂��t�̂ɍ�p���Ă���ꍇ���A �\�ʒ����Ƃ��ł��܂��B���H�͉��}�̂悤�����~����ƂȂ�܂��B �@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@  ���@�E�ʒ��̗͂͂́A�t�@���f�����[���X�͂�����������قǑ傫���Ȃ�܂��B�t�@���f�� ���[���X�͂Ƃ́A�d�ׂ������Ȃ����q�E���q�Ԃł͂��炭�ÏW�͂ŁA���q�ʂ╪�q�ʂɔ�Ⴕ �܂��B ���āA�����ɓ���܂��B�n�߂̎����́A���i�ڎ��j�ɂ��낢��ȑ傫���̌��������ē��l�� ���������܂��B���̐����P����\���܂Ŏ����Ă݂܂����B |
| �����i�P�j |
 |
 |
| �T�����̌��������ċt���܂ɂ��܂����B | �����܂���B |
 |
 |
| �V�����̌��������܂����B | �������A �����܂���B |
 |
 |
| �W�����ł���Ă݂܂����B | ��������Đ������ڂ�܂����B |
 |
 |
| �����ɂP�O�����̌��Œ��킵�܂����B | �Ȃ�ƁA���ڂ�܂���ł����B |
 |
 |
| ���̎��肪�����Ă���̂��킩��܂��B | �����P�O�������a�̎����ǂł��B |
 |
 |
| ���𒍓����܂��B | ����܂����B |
 |
 |
| �t���܂ɂ��Đe�w�ʼn������܂��B | �w�𗣂��Ă����������Ă��܂���I |
| �@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�������� �@�@���̌��a���S�����`�V�����܂ł̏ꍇ�́A���̗ʂɊW�Ȃ��A���͗������Ȃ������B �A�@�W�����̌��ŁA�R�l����Ă݂����R�l�Ƃ������͂���āA�������ڂꂽ�B �B�@�S�l�ڂ��A�P�O�����Ŏ�������A�������Ȃ������B �C�@�����P�O�����̎����ǂŁA���l�̎��������Ă݂��Ƃ���A�t���ɂ��������ǂ̌����� �́A�������ڂ�Ă��Ȃ������B |
| �@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�l�@ �܂��A�R�b�v�ɂ�����x�̌��������Ă����͂��ڂ�܂���ł����B������\�ʒ����� �͂��͂��炢�Ă���ƍl���邱�Ƃ��ł��܂��B���̕t�߂��悭�ώ@���Ă݂�ƁA���̕� ���ŁA��C�����낤�Ƃ��Ă���̂�h���ł��܂��B���̕\�ʒ��͂���C�̐N�������� �~�߂Ă���̂ł��B�܂��A�O�q�����悤�ɁA����}��Ƃ��ăR�b�v�Ǝ�����������́i �E�ʒ����j�̂͂��炫������܂��B �������A�����傫���ƕ\�ʒ��͂őς��邱�Ƃ��o�����A�������C������A���̐��� �����o�����Ƃ��āA��������A�������ڂ�܂��B�ł�����A���������Ȃ����߂ɂ́A�� �C���N�����Ȃ����Ƃ������ɂȂ�܂��B ���̌��a���W�����Ŏ��s�������k�ƂP�O�����ł������������k�������̂́A�ǂ����A �R�b�v�Ɏ��łӂ������鎞���𗣂��Ƃ����Z�p�̍I���̈Ⴂ�ɂ��Ǝv���܂��B ���a�P�O�����̎����ǂœ��l�̎�����������A�������ڂ�Ȃ������̂Ŏ��ł��P�O�� ���͑ς�����͂��ł��B ������̎��^�����ŁA�u�P�O�����Ő����������k�̎�������Ă�����A�������� �����Ƃ��ɏ����͂������ĉ�������悤�ɂ��Ă���A��������𗣂����v�Ƃ����ӌ��� ����܂����B�ق�̏����y����ʼn������Ƃɂ���āA���̏��̑�C�����R�b�v�̒��� ��C���̍����ł��A������x����͂��������ꂽ�̂�������܂���ˁB |
| �����Q |
 |
 |
| �R�b�v�ɃA�~�����܂����B | �t���ɂ���ƌ����܂���B�}�W�b�N�Ŏg�������ł��B |
 |
 |
| �ڎ����̂��܂����B | ��ʼn������ċt���ɂ��܂����B |
 |
 |
| ������莆�����炵�Ă����ƁE�E�E | �Ȃ�Ɛ��͗����Ă��܂���B |
 |
���̑傫�����R�����ɍL���ē��l�� �����������琅�͂��ڂ�Ă��܂��� �����B�Q���������x�Ȃ̂ł��傤���H �A�~�̍ގ���A�~��Ƃ��̋��� ���W���Ă��邩������܂���ˁB �܂��A���Ԃ����鎞�ɂ��낢��� �����̉��Ŏ���������\��ł��B ���̂��ƁA���f�����\�̏ڂ��� ������������܂����B�J�ڌ��f�� �O���[�v�̓d�q�̓��ʂȖ��܂�� ��������������悤�ł��B���� ��Ȃӂ�܂��̐��������܂��B |
| �ЂƂ̌��̑傫���͂Q�����ł����B |
| ���̏ꍇ���A�����\�ʒ����ɂ���āA��C�Ɛ��̋��ڂ̗͂̊W���ێ�����A ���͂��ڂ�܂���B�F����̉Ƃɂ���U���ł����l�̎������ł��܂��B |
| �����Q�T�N�@�P�P�� �R���i���j�@ �C�I�����X�����w�ԁI�@�@�u�d�݂Ŕ��d�v�@�@ |
| �@�@�@�@�@�@�@�@�@�@�@�@�@�@�܂��A�C�I���ɂ��ĊȒP�ɐ������܂��B�@ ���ׂĂ̕����͌��q���W�܂��Ăł��Ă��܂��B���q���v���X�̓d�C�������q�j�ƁA�}�C�i�X�̓d�C�����d�q�łł��Ă��܂��B���̐��͌��q�ɂ���ĈقȂ�܂����A�ӂ���̓v���X�ƃ}�C�i�X���ł����������ēd�C�����тĂ��Ȃ������̏���ɂȂ��Ă��܂��B ���̌��q����d�q�i�|�j���͂Ȃ��ƁA���܂ł荇���Ă�����Ԃ���}�C�i�X�̓d�C�ʂ��������v���X�̓d�C�����т܂��B�t�ɓd�q�������ƁA�}�C�i�X�̓d�C�ʂ��������}�C�i�X�̓d�C�����т܂��B���̌��q���v���X��}�C�i�X�̓d�C��тт����̂��C�I���Ƃ����A�v���X�̓d�C���������̂��z�C�I���A�}�C�i�X�̓d�C�����������̂��A�C�I���Ƃ��ł��܂��B
�̂���A�C�I�����X���̊o�����͂��낢��ƍl�����Ă��܂������A������ƃA�����W�������Ėʔ����t���[�Y���l���Ă݂܂����B�i�I���W�i���Ȃ̂łǂ��ɂ��ڂ��Ă��Ȃ��Ǝv���܂��j
�P�~�� �̌������A���~�j�E���́A�C�I�����X�����傫���̂ŁA�H�����ɐڐG����ƃ}�C�i�X�̐��������d�q���c���āA�������n���������Ƃ��܂��B ����A���͗z�C�I���̐��f�C�I���i�g�{�j�ɂȂ낤�Ƃ��鐫��������܂��B�������P�O�~�� �̌��������̓C�I�����X�����������̂ŁA���ƃA���~�j�E���̊Ԃ̐H�����ɂ̓A���~�j�E�����瓺�ɂނ����āA�z�C�I���̈ړ���������A���̕\�� �ɂ͗z�C�I�����W�܂��āA�����v���X�ɑѓd���܂��B �����ɁA�d�C�̗���铹������A�v���X�ɑѓd����������}�C�i�X�ɂȂ��Ă���A���~�j�E���ɂނ����ēd�C������邱�ƂɂȂ�܂��B�i�d�q�̓A���~�j�E�����瓺�Ɉړ����܂��j �@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@ 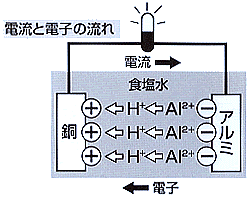 ���̂����݂́A�Q�O�O�N�قǑO�ɃC�^���A���{���^�Ƃ����l���������܂����B�u�d�����̐��n�t�ɓ��ƈ����������ƁA���̋������Ƃ��o�āA�����͓d�C�����сA�d�C�������v���ꂪ�A�d�r�̂��ƂɂȂ����{���^�̓d�r�ł��B ����̎����ł͈����̂����ɁA�����ƃC�I�����X���̑傫�ȃA���~�j�E�����g���Ă��܂��B�A���~�j�E���͓d�q���o�������Ă���̂ŁA�d�C�𗬂�������ƁA�P�~�ʂ́A�ڂ�ڂ�ɂȂ��Ă����܂��B���́A�d�q������ė��������ł�����A���͂Ƃ��܂���B |
| �����Q�T�N�@�P�O���Q�O���i���j�@�@�@���x�����d |
| ���x���𗘗p���ēd�C�ݏo���܂��@�i�[�[�x�b�N���ʎ����j �y���`�F�f�q�̕\���ɉ��x����^����Ɠd�����������܂� |
 |
 |
| �v���y�����[�^�[�����܂����B | �����e��ɔM�������A���M�����܂��B |
 |
 |
| �y���`�F�f�q��u���A�X���̂��܂��B | �v���y���������悭��]���܂����B |
| �@�@�@�@�@�@�@�@�@�@�@�i�P�j�@����������� �@�@�@�P�D�y���`�F�f�q �@�@�@�Q�D���M�� �@�@�@�R�D�����e�� �@�@�@�S�D�A���~�V���[�� �@�@�@�T�D�v���y�����[�^�[ �@�@�@�U�D��Ɍ��R�[�h �@�@�@�V�D�|�� �@�@�@�W�D�M�� �@�@�@�X�D�X �@�@�@�@  �@�@�@�@ �@�@�@�@ �@�@�@�@�y���`�F�f�q�S�O�~�S�O�����@�@�@�@�����e��ƕ��M�� �@�@�@�@�@�@�@�@�@�@�@�i�Q�j�@�����菇�ƌ��� �P�D�����e����������قǒ����A���M���̕���Ȗʂ���ɂȂ�悤�ɒu���܂��B �Q�D���M�̏���y���`�F�f�q���̂��܂��B���̎��ɂ����Ԃ��ł��Ȃ��悤�ɒ��ӂ��܂��B�|���̂悤�Ȃ��̂ʼn�������Ƃ悢�ł��傤�B �R�D�A���~�V���[���̏�ɑ傫�߂��X�����A�y���`�F�f�q�̏�ɒu���܂��B �S�D����ƁA�d�����������v���y������]���n�߂܂��B���x�����������قǐ����悭���܂��B �@�@�@�@�@�@�@�@�@�@�@�@�i�R�j�@�@�l�@ �P�D�[�[�x�b�N���� �[�[�x�b�N�����Ƃ́A���镨���̗��[�ɉ��x����^����ƁA���̗��[�Ԃ��d�ʍ�����������ʂł��B�[�[�x�b�N���ʂ͂��ׂĂ̕����Ő����܂����A�����ɂ���ēd�ʍ����قȂ�܂��B���ɔ����̍ޗ��ł͐�����d�ʍ����傫���A�M�d�ϊ��f�o�C�X�i�ޗ��j�Ƃ��Đ���Ɍ������s���Ă��܂��B �� �[�[�x�b�N���ʂ��t�̌������y���`�F���ʂƂ����܂��B����͂Q��ނ̋�����ɐڍ����Ē����d���𗬂��ƁA���̐ڍ��������z�M�����M���������錻�ۂŁA������y���`�F���ʂƂ��ł��܂��B�����悭�d�C��M�ɕϊ����邱�Ƃ��ł��܂��B���ۂɃp�\�R���̂b�o�t�N�[���[�Ƃ��Ďg���Ă��܂��B ����̎����Ŏg�����y���`�F�f�q�i���x������s�����Ƃ��ł��锼���̑f�q�j�́A�y���`�F���ʁA�[�[�x�b�N���ʂ̗����Ɏg���܂��B�[�[�x�b�N�f�q�Ƃ����̂�����܂����A�y���`�F�f�q�Ɣ�r���āA��R�l��ϋv���x�ȂǂŔ����ȍ�������܂��B �@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�[�[�x�b�N���ʂ̂����� �@�@�@�@�@�@�@�@�@�@ 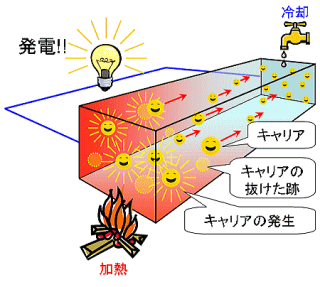 ���������M����ƁA���̓d�ׂ��������d�q�A�܂��͐��̓d�ׂ����������E�������܂��B������L�����A�Ƃ����܂��B���[�̗�p����Ă��镔���ł́A�L�����A���������Ȃ��̂ŁA�L�����A�����x�̃o�����X������A���M�������p���ɃL�����A������܂��B ���M�������ł́A�L�����A�i�d�q�̏ꍇ�͕��A���E�̏ꍇ�͐��j������o�Ă��������Ƃ́A�L�����A�Ƌt�̓d�ׂ������߁A���M���Ɨ�p���̊Ԃ��d�ʍ��������܂��B���̏�Ԃŗ��[���łȂ��A���ׂ�^���邱�Ƃœd�͂����o�����Ƃ��ł��܂��B���ꂪ�[�[�x�b�N�����ł��B �Q�D�[�[�x�b�N���ʂ��g�������x�����d�̎��p�� ���@�M�C�s�g�o��� �����Q�S�N�P�O���T���i���j����A���O�_�Ћ����߂�������i���ۓ��j�̓��C�Ɛ��̉��x�������p�����ቷ�x�����d���u��ݒu���Ă��܂��B���d�����d�͂O�_�Ћ����܂Ŗ�S�O�����d���A�S�̃A�v���P�[�V�������ғ������Ă��܂��B �@�@�@�@�@�@�@�@�@�@�@�@�ቷ�x�����d���u
�@�@�@�@�@�@�@�@  ���x����d���ɕς���[�[�x�b�N���ʂ́A������190�N�قǑO���g�[�}�X�E�[�[�x�b�N�ɂ���Ĕ������ꂽ�����B�c����w�̕��������͂��̌��������p��������̔M�Ɛ��Ƃ̉��x�������p�����ቷ�x�����d���u�̊J���Ɏ��g�܂�Ă��܂��B
���ڂ��ׂ��_�́A���̔��d���u�͔M�d�f�q�Ƃ��Ĕ��d��p���[�[�x�b�N�f�q�𗘗p���A�q�[�g�p�C�v��f�q�ɐڑ����ĔM�`���̂Ƃ��邱�ƂŁA�M���̐^�̉��x�����`������Ƃ��̉��x���ނ����ł͂Ȃ��A�ψ�ɓ`���邱�Ƃ��\�ƂȂ��Ă��܂��B
����̑��u�͌��甭���������C�i��100���j���������i��20���j�Ƃ̉��x���𗘗p���A���x����d�C�ɕϊ�����[�[�x�b�N�f�q�i�M�d�f�q�j�Ŕ��d���Ă��܂��B���u�̍\���́A�M�d�f�q�ł���[�[�x�b�N�f�q�i4cm�l���j�̗����Ƀq�[�g�p�C�v�e5�{��1���j�b�g�Ƃ���5�A�ɂ������u�Ŗ�15�v�̔��d�����Ă��܂��B �@�@�@�@�@ 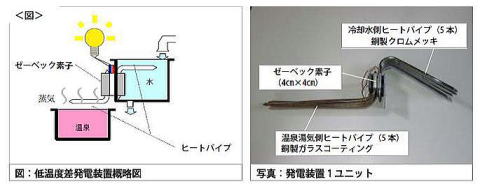
�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�e�[�}�@ �@�u����̔M��M�d�f�q���g���ēd�C�G�l���M�[�ɕϊ�������v �@�@�@�ړI�@�@���Ɍ��E�Z�b�R�i���̓c�Ɂj�̗L�n����̊����� �M�C�̉���̎��p����Q�l�ɁA�L�n���������x�����d���g���āA�o�ϊ������ɗ��p�ł���̂ł͂Ȃ����ƍl�����B���R�͂Q����B �P�߂́A�Z�b�R�ɂ͗L�n������A�n���ɂ��L�x�ȔM�G�l���M�[�����݂��A�\���ɔM�����m�ۂł���Ƃ������Ƃł���B �Q�߂́A�Z�b�R�͓~�A���ɋC����������B���̂��߁A�~��͐����ǂ̒��̐�������A�X�L�[��ȂǏW�q�������߂�ꏊ�ł���̂ɂ�������炸�A����ꂽ�ꏊ�ł����A�����g�p�ł����A�\���ȋ����ݔ������킸�A�~�̊ό��q�������Ă��܂��{�݂�����̂����B ������������邽�߂ɁA���x�����d�𗘗p���邱�Ƃ��v�������B����͉��x�����d�Ŕ��������d�C�������ǂ����߂�q�[�^�[�Ɏg���Ȃ����ƍl�����炾�B �������A����ɂ͂P�̉ۑ肪����B����́A�L�n����̉��������Z�x�����ɍ����Ƃ������Ƃ��B�����Z�x�������ƔM��������ǂ̕��H�������A�����e�i���X�╔�i�����ȂǂŁA�R�X�g���ƂȂ��Ă��܂��B �����ŁA�c����w�̕������������ǂ����悤�ɁA�ǂډ��ɂ͓��ꂸ�A�q�[�g�p�C�v���g���A����̏��C�ɂ��Ă邱�Ƃɂ���Ε��H�Ƃ������͉����ł���B�Ȃ��Ȃ�A���̕��_�͐������͂邩�ɍ������炾�B �܂��A�Z�b�R�̒n�ʂ͓~��͓����Ă��āA�n�\�ʂƁA�n���̃}�O�}�ɂ�鍂���ɂ���āA���x���͏\���Ɋm�ۂł���ƍl������B ���̂悤�ɂ���A�������炸�ɏ\�������ł���悤�ɂȂ�A���H�E���W���[�Ȃǂɗ��p�ł��A�~�ł��ό��q���W�߂��悤�ɂȂ�A����n�悪�������ł���̂ł͂Ȃ����Ǝv���B �@�@�@�@�@�@�@�{�݂̗��p�g�剻 �@�@�@�@�@�@�@�@�@�@�@�� �@�@�@�@�@�@�@�@�����ǂ̓����h�~ �@�@�@�@�@�@�@�@�@�@�@�� �@�@�@�@�@�@�@�@�n���������߂� �@�@�@�@�@�@�@  �@�@�@�@�@�@�@�@�@�q�[�g�p�C�v �@�@�@�@�@�@�@�@�@�@�@ �@�@�@�@�@�@�@�@�@�[�[�x�b�N�f�q �@�@�@�@�@�@�@  �@�@�@�@�@�@���̔M���C�i�����͂Ȃ��j �@�@�@�@�@�@�@  �@�@�@�@�@�@�@�@�@�@�}�O�} |
| �����Q�T�N�@�P�O���P�R���i���j�@�@�@�@���V |
| �@�d���̓������x�[�X�ɁA�n���i���Ɏ��������Ă��܂��j�����܂��B |
 |
 |
| �����|�C���g���������Ă��܂��B | ���͂Əd�͂̔����ȃo�����X�ł��B |
 |
 |
| ���C�g�A�b�v���ł��܂��B | ���������o���Ă݂܂����B |
 |
 |
| ��������]���܂��B | ����ɂ��́I |
| ��������v���X�`�b�N�̒n���̒��ɂ��i�v�����i�l�I�W���H�j�������Ă��܂��B�܂��A�A�_�v�^�[ �Ɛڑ����Ă��鉺�̃X�e�[�W�̒��ɂ́A�S�̏������d�����ƁA�����H���g�ݍ��܂�Ă��܂��B ���̂����A�悹�����̂��X�e�[�W�̊O�ɔ�яo���Ă��܂��̂�h���ł��܂��B�܂��A�d���� �̗͂���ׂɕω������邱�ƂŁA���]��U�����Ă��܂��B�i��������]���܂��j
�@�@�@�@�@�@�X�e�[�W���ʐ} �@�@�@�@�@�@�@�@�@�@  �@�@�@�@�@�@ �@  �@�@�@�@�@ �@�@�@�@�@ �@�d���@�@�@�@�@�@�Z���T�[�@�@�@�@�d���� �@�@�@�@�@�@�@�@�@�X�e�[�W���ʐ} |
| �����Q�S�N�@�X���Q�R���i���j�@�@�@�@�S���̐L�k���� |
 |
 |
| �S�������߂�ƐL�т�H�k�܂�?�Ƃ��������ł��B | ���߂�O�ł��B |
 |
 |
| �K�X�o�[�i�[�ʼn��߂Ă݂܂����B | �T�����قǏk�܂�܂����B |
| �S���̌����ł����V�R�S���͒������̂悤�ȍ����q�łł��Ă��܂��B�S���̕��q�͂��̒��������ג����������̂悤�ɂ���݂�������ԂɂȂ��Ă��܂��B �փS���ɔM��������ƕ��q�������Ă�����������Ԃ̂����Ԃ߂��悤�ɏ������Ȃ낤�Ƃ��ăS���͏k�܂�܂��B ����������O�ɁA�P�D�L�т�@�Q�D�k�ށ@�R�D�ς��Ȃ��̎O���Ŗ����o�����Ƃ���A���𗦂͂Q�T���ł����B |
| �@�����Q�S�N�@�V���P�T���i���j�@�@�A���R�[�����P�b�g |
| �l�H�������ɂ���Đ��f����A���R�[�����ł���Ƃ������Ƃ̌�A�݂�ȂŃA���R�[����R���ɂ������R�b�v���P�b�g�����܂����B |
 |
 |
| �i�`�w�`���炢������������ | ����܂��B |
 |
 |
| �܂�Ȃ��܂��B | ���R�b�v�ɂ��܂��B |
 |
 |
| �����ł��B | �G�^�m�[�������܂��B |
 |
 |
| ���Ԃ��܂��B | �`���b�J�}���Ŕ��ˁI |
| �܂��A�ʂ̒ꂩ��Q�����̈ʒu�ɁA����Œ��a�S�������x�̌����J���܂��B ���Ɉ�������ʂ̒��ɖ��������G�^�m�[�����Q�`�R�˂��܂��B�����Ă��₭���R�b�v �����Ԃ��܂��B �ォ�玆�R�b�v�łӂ��������Ƃɂ���āA���R�b�v�Ƌʂ̒��͔����G�^�m�[���̏��C�Ŗ����� ��܂����B�����āA����Ō����J�����ꏊ�ɓ_�����`���b�J�}�����߂Â��܂��B�����邱�ƂŁA �G�^�m�[���͔����R�Ă��A�̐ς���C�ɑ������܂��B ���̎��ɐ�����͂ɂ���āA���R�b�v�͐����悭�V��ɑł��グ���܂��B���@�������鎞�ɂ́A �V��̏Ɩ��ɂ�����Ȃ��悤�ɋC�����ĉ������B�܂����˒���̋ʂ��M���Ȃ��Ă����̂� �����G��Ȃ��悤�ɁE�E�@�܂����S�̂��߂��G��G����p�ӂ��Ă����܂��傤�B |
| �@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�����Q�S�N�@�R���S���i���j �@�@�@�@�@�@�@�@�h���C�A�C�X�̉�����������o�����@�́H |
| ��� |
| �R�b�v�̒��ɐ������āA���̒��Ƀh���C�A�C�X������Ǝn�߂͔��� �����o�Ă��܂����A���炭����ƃh���C�A�C�X�͎c���Ă���̂ɉ����o �Ȃ��Ȃ��Ă��܂��܂��B�ǂ̂悤�ɂ�����Ăщ����o�Ă���ł��傤���B ���ɗn����l�q���ώ@���ďq�ׂȂ����B���������̗��R�������Ȃ����B |
�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@����͋L�q���ɂ��܂����B
�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�܂��A�h���C�A�C�X�𐅂ɗn�����Ă݂܂��B
 |
 |
| �R�b�v�Ƀh���C�A�C�X�����܂��B | ���𒍂��܂��B |
 |
 |
| �����o�Ă��܂����B | ���̃h���C�A�C�X���悭���Ă݂܂��傤�B |
| ���̑O�Ƀh���C�A�C�X����o�Ă��锒�����͈�̉��ł��傤���H�h���C�A�C�X����_���Y�f���ł߂����̂�����E�E�E��_���Y�f�I�ƌ��������Ȃ�܂����A�c�O�Ȃ��炻��͈Ⴂ�܂��B�m����_���Y�f�����F�E���L�ŖڂɌ����Ȃ������͂��ł���ˁB ���͂���́A�C��������_���Y�f�ɗ�₳�ꂽ��C���̐����Ȃ̂ł��B���̏����ȗ������ƂȂ��Č����Ă��̂ł��B�_�Ɠ����悤�ȏ�Ԃƍl���ĉ������B |
�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�����̎��������Ă݂܂��傤�I
 |
 |
| ��قǂ̃R�b�v�ɒ��ɂ��������܂��B | �h���C�A�C�X���Ăїn���n�߂܂����B |
 |
 |
| �R�b�v�����ς��ɂȂ�܂����B | ���x�͎n�߂ɂ��������Ă����܂��B |
 |
 |
| �h���C�A�C�X����ꂽ�u�Ԃł��B | �ΎR�̕��̂悤�ɕ����o���Ă��܂��B |
 |
 |
| �����g������C�C�̎����ł��B | �������܂����B |
�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@
| �������߂ċ�C�C�̎�����lj����悤�Ƃ��܂������A�h���C�A�C�X���������Ȃ褉����o�܂���ł����B ��C�����Ŏ������܂������A���܂��A�낤�����̉������܂����B����Ɏ����z���ɂ��܂��B |
| ���̏ꍇ�A���������o�Ȃ��Ȃ�̂́A�h���C�A�C�X�̕\�ʂ��X���ł��Ă��܂��A�h���C�A�C�X���� ���܂��̂������ł��B�ʐ^������ƕX���ł��Ă���̂�������܂��B���ꂪ�̎肪����ɂȂ� �܂��B ���������ꂽ��A�����o�n�߂�̂͂������\�ʂ̕X���n��������ł��B�ł�����X��n�����悤 �ȕ��@�������܂��B���ɂ��ǂ�ȕ��@�����邩�l���Č��܂��傤�B �ʐ^�̂悤�Ɏn�߂��炨��������Ɛ��������������o�āA���������������܂��B����͉f�� �̎B�e���ʂɂ��g���Ă��܂��B |
| �����Q�S�N�@�Q���P�X���i���j �@ �P�H�̐��̒��ɐ����q�i�g�Q�n�j�͂�������H |
| ��� |
| �@�@�@�@�@�@�@�@�@�@�@�@�@���ˊ킩��P�H�̐��𐂂炵�܂��B �@�@�@�@���Ă��̒��ɂ͐��̕��q�͂������炢�����Ă���ł��傤���H �@�@�n���̐l���i��V�O���j�̏\���̈�@�@�A�@�l���Ɠ������炢�@�@�B�@�l���������� |
�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�������Ă݂܂��傤�I
 |
 |
| ���R�b�v�E���ˊ�E�͂��� | �R�b�v���悹�Ėڐ�����O�ɂ��܂����B |
 |
 |
| �����z���グ�Ă��܂��B | ��H�����炵�Ă����܂��B |
 |
 |
| �R�b�v�ɗ��߂Ă����܂��B | �P�O�O�H�߂ł��B |
 |
 |
| �d����ʂ�܂��B | �V�D�T���@����܂����B |
�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�����A�v�Z���Ă݂܂��傤�B
| ���͉��w�����g�Q�O�ƕ\����A�_�f���q�Ɛ��f���q���Q���т��āA�����q�P���ł��Ă��܂��B ���q�P�͂ƂĂ��y���̂ŁA��̌��q���U�D�O�Q�~�P�O�Q�R���W�߂����̏d���ōl���܂��B �U�D�O�Q�~�P�O�Q�R�W�߂����̊e���q�̏d�������q���ƌĂсA�U�D�O�Q�~�P�O�Q�R�Ƃ��������A�{�K�h���� �Ƃ����܂��B�����ĂU�D�O�Q�~�P�O�Q�R�̓��ꗱ�q�̏W�c���P�����imol�j�Ƃ����P�ʂŕ\���܂��B �����Đ��f�̌��q�ʂ����P�D�O�O�W�A�_�f���P�U�D�O�O�Ȃ̂ŁA�����q�P�́A�P�D�O�O�W�~�Q�{�P�U�D�O�O �����P�W�D�O�Q�ƂȂ�܂��B����������P�W�D�O�Q���̐��̒��ɂ́A�U�D�O�Q�~�P�O�Q�R�̐����q���� �܂�Ă��邱�ƂɂȂ�܂��B �U�D�O�Q�~�P�O�Q�R���ǂ̂��炢�̐����ƌ����ƁA�Ⴆ�Ώ����ȍ��̈ꗱ���U�D�O�Q�~�P�O�Q�R�W�܂�� �x�m�R�R�O�����炢�̑傫���ɂȂ�܂��B������Ƒz�������ɂ��������ł��ˁB ���@�����̌ꌹ�́A���e�����moles���炫�Ă��āA�u�ЂƎR�v�Ƃ��u�ЂƂ����܂�v�Ƃ����Ӗ��ł��B �����ł͒��ˊ�̐悩���H���������R�b�v�̒��ɐ��炵�Ă����܂����B�����Ă��傤���P�O�O�H�A ���炵�����_�ŏd����ʂ����Ƃ���A�V�D�T������܂����B�P�O�O�H�łV�D�T���Ȃ̂łP�H�̏d���͂V�D�T���� �P�O�O���O�D�O�V�T���ɂȂ�܂��B ��������͏��w�Z�Ŋw�����̌v�Z���g���܂��B���P�W���̒��ɂ́A�U�D�O�Q�~�P�O�Q�R�̐����q�� �܂܂�Ă��܂��̂ŁA���O�D�O�V�T���̒��ɉ��̐����q�����邩���w���Ƃ����Čv�Z���Ă݂܂��傤�B �@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�P�W�@�F�@�U�D�O�Q�~�P�O�Q�R�@���@�O�D�O�V�T�@�F�@�w �@�@�@�@�w�@���@�O�D�O�V�T�@�~�@�U�D�O�Q�~�P�O�Q�R�@���@�P�W�@���@�Q�D�T�~�P�O�Q�P���@�ƂȂ�܂����B �@�@�@�@�Q�D�T�~�P�O�Q�P�́A�Q�T�O�O�O�O�O�O�O�O�O�O�O�O�O�O�O�O�O�O�O�O�ł��B�i�Q�T�����j
���ˊ킩��o�鏬���Ȑ��H�̒��ɂł����A����قǑ����̐����q�������Ă����̂ł��B�F����̉� �̐����̎�����o�鐅��H�͂����Ƒ傫���̂ŁA������Q�{�ȏ��͓����Ă���Ǝv���܂��B �@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@ �@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@ �@ �������B�ł������A�n���̐l���Ƃ͔�r�ɂȂ�Ȃ��قǑ��������̂ł��B���ˊ�̐�̏����Ȑ��H �̒��ɂ́A���ƒn���̐l������R�O�O�O���{�̐����q�������Ă����̂ł��B���������n���̕\�ʂ� �V�O�����߂�C�̒��ɂ͉��̐����q������̂ł��傤���H�@�C�������Ȃ肻���Ȑ����ł��ˁE�E�E �@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@
�@���@���f�̌��q�ʂ��P�D�O�O�W�Ƃ��������ł��B�i���Z���e�Ȃ̂ŏ��������������܂���j ���q�ʂƂ́A�Y�f���q�P�Q�b�̎��ʂ𐳊m���P�Q�Ƃ��A�������ɂ��āA���錴�q�̎��ʂ������� �l�ɂȂ邩�Ƃ������ΓI�Ȏ��ʂ�\���������ł��B �@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@ 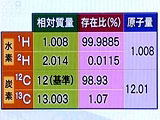 ���R�E�ɑ��݂��鐅�f�̂قƂ�ǂ́A�����q�������Ȃ��i�z�q�Ɠd�q���e�P���j�̂ł����A�����q �������f���ق�̂킸���ł������݂��܂��B��Q�{�̏d���ɂȂ�܂��B�d���f�Ƃ������ʑ��ł��B ���ʑ̂Ƃ͗z�q�̐����������A�����q�̐����قȂ錴�q�ł��B ���f�̌��q�ʂ́A�e���ʑ̂̑��Ύ��ʂɑ��ݔ�i�d���f�͂O�D�O�P�P�T���j�������Čv�Z�������ϒl ���p�����Ă��܂��B�����q���Q����R�d���f�i�g���`�E���j�Ƃ����̂�����܂����A����͓V�R�� �ɂ͑��݂��܂���B����Ōv�Z����Ɛ��f�̌��q�ʂ��P�D�O�O�W�ɂȂ�܂��B �@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@ �@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�d�q�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�d�q �@�@�@�@�@�@�@�@�@�@�@�@�@�@ �@�@�@�@�@�@�@�@�@�@�@�@�@�@�z�q�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�z�q�E�����q �@�@�@�@�@�@�@�@�@�@�@�@�@���f�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�d���f �������_�f�̌��q�ʂ����������ڂ�������ƁA�P�T�D�X�X�X�S�ɂȂ�܂��B�_�f�̈��肵�����ʑ̂͂R��� �ŁA�P�U�n�A�P�V�n�A�P�W�n������܂��B�V�R�̑��ݔ���P�U�n���X�X�D�V�U�Q���A�P�V�n���O�D�O�R�V���A�P�W�n�� �O�D�Q�O�S���ɂȂ�܂��B���̑��A�����ː����ʑ����P�S��ނ���A���ʐ��i�z�q�{�����q�j�͈̔͂� �P�Q�`�Q�W�ł��B ���@���ː����ʑ� ���q�̓��ʑ̂̒��ɂ́A���q�j���s�����ŁA���q�j�����R�ɉ��Ă������̂�����܂��B���̎��A ���q�j����́A�����A�����A�����Ȃǂ̋����G�l���M�[�����������ː������o����܂��B���̂悤�� �����������ʑ̂��A���ː����ʑ́i���W�I�A�C�\�g�[�v�j�ƌĂ�ł��܂��B ���ː����ʑ̂̒��ŁA�O�q���R�g�i�g���`�E���j�͐��̓��ł̌��f�̒ǐՁA�P�S�b�͈�ՂȂǂ̖ؕ� ����i�Ɋ܂܂���P�S�b�̗ʂŔN�オ�킩��܂��j�A�U�O�bO�i�R�o���g�U�O�j�́A�K���̎��ÂȂǂɗ��p ����Ă��܂��B |
| �����Q�S�N�@�Q���T���i���j�@�@�l�M��L���E�������H |
�@
| ��� |
| �@�@�������Ńl�M��L���E���𒆉��Ō��сA�ォ��邵�܂��B �@�@�����Ƀ^�I���ł��������A�N�����̃p�C�v���߂Â��܂��B �@�@�@�@�@�@�@�@�@��͂ǂ̂悤�ɓ����ł��傤���H �@�@�p�C�v�ɋ߂Â��Ă���@�@�A�p�C�v���牓������B�@�B�㉺�ɗh���B |
�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@���̑O�ɊȒP�Ȏ��������܂��傤�I
�@
 |
 |
| �����Ɏg�����̂ł��B | �A���~�z�C����������������܂��B |
 |
 |
| ���̂܂܂ł̓X�g���[�ɂ��܂��E�E | �e�B�b�V���y�[�p�[�ł�����Ƃ��܂����B |
| �Ód�C���N���邵���� |
�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@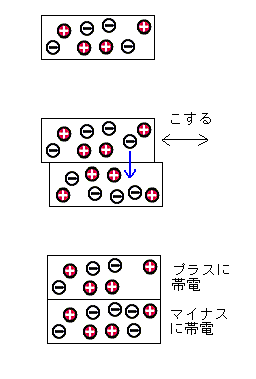
| �Ód�C�Ƃ͂Q��ނ̕����������荇�킹���Ƃ��ɕ������тт�d�C�̂��Ƃ������܂��B �����ɂ́A�{�Ɓ|�̓d�C����������������܂����A���C�ɂ��A�|�̓d�C���ړ����܂��B ����́{�̓d�C�A�����́|�̓d�C��тт܂��B �v���X�`�b�N�̃X�g���[�͖��C�ɂ���ā|�̓d�C��тсA���ꂪ�A���~�z�C���������� �܂����B�Q��ނ̕����C�����Ƃ��A�d�q���ǂ̂悤�Ɉړ����邩�́A���ΓI�ɂǂ��� �̕������d�q����荞�݂₷�����Ō��܂�܂��B���̖т�K���X�E�r���́A�{�ɑѓd�� �₷���A�|���G�`�����E�Z���t�@���E�����r�j�[���Ȃǂ́A�|�ɑѓd���₷���Ȃ��Ă��܂��B |
�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@���Ď��́A���ɂ���l�M�ƃL���E���̓o��ł��B
�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@ �@�@
�@�@
| �˂��ƃL���E�������ł邵�܂��B�����փ^�I���ł��������A�N�����p�C�v���߂Â��܂��B |
 |
 |
| �p�ӂ������ | ���������Ō��т܂��B |
 |
 |
| �邵�܂��B | �p�C�v�Ɉ������܂����B |
 |
 |
| �������������悤�ɋ߂Â��Ă��܂��B | ���x�̓L���E���ł��B |
 |
 |
| �������܂��B | ��]���n�߂܂����B |
| �����͇@�ł����B |
| �l�@ |
| �l�M��L���E���ɂ͐����������܂܂�Ă��܂��B���̕��q���悭���Ă݂�ƁA�_�f���q�́A �d�q���������鐫���������̂ŁA���f���q�̓d�q�͎_�f���q�̂ق��Ɉ������� ���܂��B���̂��߁A�_�f���q�̕����ł̓}�C�i�X�̓d���A���f���q�ł̓v���X�̓d���� �����Ȃ�܂��B ���ۂɂ͐��̕��q�̒��ł́A�v���X�A�}�C�i�X�̓d�ׂ̕��z�ɕ肪�ł��Ă���̂ł��B ���̂悤�ȕ��q�̐������u�ɐ��i���傭�����j������v�Ƃ����Ă��܂��B ���̕��q���}�C�i�X�̓d���i�����̃A�N�����p�C�v�̓}�C�i�X��ттĂ��܂��j���߂Â��� ����ƁA�v���X�̓d�ׂɕ��������A�܂����f���q�̕��������������܂��B �܂��A�v���X�̓d�ׂ����������̂��߂Â��Ă���A���̒��̃}�C�i�X�̓d�ׂɕ����� ���A�܂�_�f���q�̕��������������܂��B ���̂悤�ɁA�����܂��̂̊O����}�C�i�X�A�v���X�̂ǂ���̓d�ׂ��߂Â��Ă��A���� ���q�͈�������邱�ƂɂȂ�܂��B�l�M��L���E����������̂����̗��R����ł��B |
| �@�g�Q�n |
�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�_�f���q �O�i�}�C�i�X�������j
�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@
�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@���f���q �g�@���f���q �g�i�v���X�������j
| �@�@�@�@�@�@�@�@�@�@�@�����Q�S�N�@�P���Q�X���i���j�@ �@�@�@�@�@�@�@�@�g�уJ�C���͂ǂ����ĉ������Ȃ�́H |
| ��� |
| �@�@�J�C����܂���o���Ă悭�U��Ɖ������Ȃ�̂͂Ȃ��ł��傤���H �@�@�@�@�@�@�@�@�@�@�@�@�@  �@�@�@���Ƃ��ƃJ�C���̒��ɓ����Ă��镨���ǂ������������邩�� �@�A�@�J�C����U�����Ƃ��̖��C�ɂ���ĔM���������邩�� �@�B�@�J�C���̒��ɓ����Ă��镨���Ƌ�C���̎_�f���������邩�� |
�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�����Ŋm���߂Ă݂܂��傤�I
 |
 |
| �y�b�g�{�g���E���E�͂��݁E�J�C�� | �����߂Â��Ă݂܂��B |
 |
 |
| �J�C�������܂����B | ���̕����y�b�g�{�g���ɓ���܂��B |
 |
 |
| �������Ȃ��Ă��܂����B | �悭�U���āA�P�O����ł��B |
 |
�����͇B�ł����B �y�b�g�{�g���̂Ԃꂽ���̑̐� �͋�C���̎_�f���ɑΉ����܂��B �_�f���S���̒��ɓ������̂ł��B ���̂悤�ȕω����_���Ƃ����܂��B |
| �P���o����������Ƃւ���ł��܂����B |
| �@�l�@ |
| �J�C���̒��g�͉��Ȃ̂��H�܂̗���������Ƃ��낢��Ə����Ă���܂��B �S���E���E�����Y�E�H���E�o�[�~�L�����C�g�E�z���������Ȃǂ������Ă��܂��B �����Ŏ����߂Â���ƃJ�C�������܂������A����͒����S���������� ����ꂽ����ł��B ���ɓ����Ă���S�����A��C�����_�f�ƐG���ƁA�������n�܂�M�� �����̂ł��B�܂��J�C����܂�����o���Ă���U��Ɖ������Ȃ�̂́A�J�C ���̒��ɋ�C�����_�f�����荞����������n�܂邩��ł��B �܂��J����O�ɃJ�C����������U���Ă��A�܂̒��ɂ͎_�f���Ȃ��̂ŁA���� �͎n�܂�܂���B�܂艷�����Ȃ�܂���B�@�A�A�������ł����畕���� ���Ă��܂�G��Ή������Ȃ��Ă���͂��ł��B �Ƃ���ŁA�J�C���̒��ɓ����Ă����H���͉��̂��߂ɓ����Ă���̂ł��傤 ���H���́A�S���Ǝ_�f�����₷�����邽�߂ɓ�����Ă���̂ł��B ���̂悤�Ȃ͂��炫�����镨�����G�}�i���傭���j�Ƃ����܂��B �������A�H���͗��̂܂ܓ����Ă���̂ł͂Ȃ��A���ɗn�����Ċ����Y��o�[ �~�L�����C�g�i�_�Ƃ≀�|�Ɏg���ې����̂���y�j�E�z���������ɂ��݂��� ���Ă���܂��B |
| �@�@�@�@�@�@�@�@�@�����Q�R�N�@�P�Q���Q�T���i���j�@ �@�@ �@�@�@�@�@�e�B�[�o�b�O���g���̒��ɓ����ƁH |
| ��� |
| �J�b�v�̒��ɐ������Ă��̒��ɍg���̃e�B�[�o�b�O���ɕt���Ȃ��悤�� �����܂܂ɂ��܂��B���Đ��̓������J�b�v�̏d���͌y���Ȃ�ł��傤���H �d���Ȃ�ł��傤���H�܂��͕ς��Ȃ��ł��傤���H �@�@�@�@�@�@�@�@�@�@  �@�@�@�@�@�@�@�@�y���Ȃ�@�@�@�A�@�d���Ȃ�@�@�B�@�ς��Ȃ� |
�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�������Ă݂܂��傤�I
 |
 |
| �����{�g���E�J�b�v�E�e�B�[�o�b�O | �J�b�v�ɐ������܂��B |
 |
 |
| �d����ʂ�܂��B | �Q�W�V������܂����B |
 |
 |
| �e�B�[�o�b�O���ɂ��Ȃ��悤�ɓ���܂��B | �d����ʂ�܂��B |
 |
�@�����͇A�ł����B |
| �Q�X�T������܂����B |
| �l�@ |
| �J�b�v�̏d���͊m���ɑ����Ă��܂����B�ǂꂾ�����������Ƃ����ƁA�e�B�[�o�b�O�� �͂��炭�����ɓ������傫���̏d�݁i�́j�ł��B ����������̗͂��e�B�[�o�b�O�ɋy�ڂ��Ă���Ƃ��A�e�B�[�o�b�O�͐��ɕK���A �傫�����������t�����̗����y�ڂ��Ă���̂ł��B ������j���[�g���̑�R�@���ƌĂ�ł��܂��B�u�P�̕��̂`�����̕��̂a�ɗ͂� �����Ă���Ƃ��A���̂a�͕K�����̂`�ɁA�傫�������������������̗͂� ��p����ŋy�ڂ��v�@���̖@���͒��w�Z�ł��h��p�E����p�̖@���h�Ƃ������O �Ŋw�K���܂��B����͉^�����Ă���ꍇ�ɂ����藧���܂��B �@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@��p �@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@  �@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@  �@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@����p ���@���j�Ń^�[�����鎞�ɑ��Ńv�[���̕ǂ��R��Ǝv���܂����A���̎��A�ǂ��� �Ȃ��������Ԃ��Ă���Ă���̂ł��B���̗͂őO�i�ނ��Ƃ��ł���̂ł��B �@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@ |
| �����Q�R�N�@�P�P���Q�V���i���j �@�@�@ ��ɏ�����̂͂ǂ����H |
| ��� |
| �K���X�r���̒��ŁA�����낤�����ƒZ���낤����������ł��܂��B���̓�{�̂낤�����ɉ����A �r���ɂӂ�������Ɛ�ɉ���������̂́A�ǂ���̂낤�����ł��傤���H �@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@  �@ �@�@�@�@�@�@�@�@�@�@�@�����낤�����@�@�@�A�@�Z���낤�����@�@�@�@�B�@�����ɏ�����B |
�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�������Ă݂܂����B�i�O�̂��ߑ傫�߂̂ʂ�G�Ђ��߂��ɂ����Ă����܂��傤�j
 |
 |
| �`���b�J�}���ʼn����܂��B | ���������ĔR���Ă��܂��B |
 |
 |
| ���₭�r���ɂӂ������܂��B | ����������ɏ����܂����B |
�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�w�@�ł̐��𗦂͂T�O���ł����B����Ǝv���܂����������̐��k�������ŁA�т�����ł��B
| �l�@ |
| �̂����낤�����͎_�f������A�����ɓ�_���Y�f����o���܂����A�F����͏��w�Z�� �_�f������_���Y�f�̕����d���i���x�������j�Ƃ������Ƃ��w�K�����Ǝv���܂��B �ł������_���Y�f���r���̉��̕��ɂ��܂�A�Z���낤�����̕�����ɏ�����Ɠ�����l�� �����Ǝv���Ă����̂ł����E�E �ł����ۂ͒����낤�����̕�����ɏ����܂����B���̗��R��������܂��B �������o������_���Y�f�̉��x�������Ȃ���A�Z��������ɏ����܂��B���������ۂɂ� �r���̒��̓�_���Y�f�������ŁA�����r���̒��̎_�f�����y���i���x���Ⴂ�j��Ԃɂ��� �̂ł��B ���@�W����ԁi�O���E�P�C���j�ł́A�_�f�̖��x����P�D�S���^���b�g���A��_���Y�f�̖��x�́A ��Q�D�O���^���b�g���ł��B���������x���P���㏸���邲�Ƃɖ�Q�V�R���̂P���̐ς������� ���߁A�퉷�̎_�f���������̓�_���Y�f�̕����y���i���x���������j�Ȃ�A�r���̏���� ���܂��Ă����̂ŏ�̕��ɂ��鉊����ɏ����Ă��܂��̂ł��B ���w�Z�̎����ŁA�P�{�̂낤�����ɉ����A����ɃR�b�v�����Ԃ���Ɖ������������ �����Ǝv���܂����A����́A�_�f���g����Ɠ����ɓ�_���Y�f�͏㏸���A��ɂ��܂��� �낤�����ɍ~���Ă���悤�Ȋ����Ȃ̂ł��B�i��_���Y�f�͏㕔�ł��炭�Η������܂��j �����珙�X�ɂ��܂��Ă���̂ł͂Ȃ��̂ł��B |
| �m�����z |
| ���̎����́A�������\������ނ̂ɍœK�Ȏ������Ǝv���܂��B����̃N�C�Y�ł� ��_���Y�f�͎_�f�����d���i���x�������j�Ƃ����m�������ł͓����邱�Ƃ͂ł� �܂���ł����B�w�͂̂��Ȃ荂�����k�ł��A�i�Z�����j�Ɠ����Ă��܂��܂����B �ł���Ȃ̂͂��̌�ł��B�Ȃ������낤�����̕�����ɏ�����̂��낤�Ƌ^������� ���Ă����T����������ė~�����̂ł��B�w�K�̌��ʓ�����m���̗ʂ� ������x�A ���܂��Ă��܂��B�����������ł͎��R���ۂ���^��E��������͂�A���̋^��� �������Ă�����ŁA�Ȋw�I�Ȍ�����l�������ł���\�͂��K�v�ƂȂ��Ă��܂��B ���w�P�N���ł��낢��ƍl�������A�u�����C���㏸���ĉ��������v�Ɠ��������k����l ���܂������A������V�C�̏㏸�C������v���������j�[�N�ȓ����ł��B �u�����Ŏ�����ώ@���s���A�����̗͂ōl���A�����̗͂Ŗ��������ł����v�Ƃ��� ��сi�y�����j����Ă��������B���̂悤�Ȏ�̓I�Ȋw�K���@�͗��n�E���n�� �W�Ȃ��A�����Ƃ��Ȃ��̖����ɖ𗧂͂��ł��B |
�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�P�Q���P�U���i���j�_�ސ�V���h�Ɩ����h���
| ����14���t���u�q�b�O�X���q�������v�̋L����ǂ݂Ȃ���A�u�S�p�[�v�Ȃǂƌ����Ă���킪�g����Ȃ��Ȃ����B���{���Q�����Ă��鍑�ی����`�[���́A���̂������ʂ̋N���Ƃ����q�b�O�X���q�̔����ɋ߂Â����Ɣ��\�����B���݂���m���炵����98�E�X���Ƃ��� �g�S�p�[�l�ԁh���猩��u���������v�ł�������Ȃ����Ǝv���B�������A�錾�ł���̂�99�E�X�X�X�X���ȏゾ�B�����f�[�^������ɒ~�ς��A���N�̍ŏI��ڎw���B�Ȋw�̐������̂悤�Ȃ��̂���������Ȃ� ���w���m�E�Ζ،���Y�A�T�C�G���X��ƁE�|���O�̗����́A�Βk�W�u�R�E11�Ȍ�v�i�����I���j�ŁA�����d�͕�����P�������̂ɑ�����{�l�̑ԓx�ɂ��Č�荇���Ă���B�Ζ���͒m���◝���Řb�����A����I�ň���I�ȕ�����������l���������Ǝw�E�B�|������͉Ȋw��`�̍����ł����u���߂��Ȃ��v�u�������d��v���Ƃ��c�_�̏�ŏd�v���Ǝ咣���� ����_�ɗ���邱�ƂȂ������̃G�l���M�[�����l�������Ǝv���Ă��A�Ȋw�I�Ȏv�l�����Ȑl�������B�킪���̉Ȋw����̕n�������ᔻ����邪�A���̃c�P������Ă��Ă���B |
���q�b�O�X���q�ɂ��Ắh�m���̐��E�}���h�@�m���D�T�u�V�́v�ɉ�����Ă���܂��B
�@
click
| �@�@�@�@�@�@�@�@�@�@�����Q�R�N�@�P�O���P�U�� �@�@�@�@�@�@�@�@�u�`�@�F�@�n�M���d�̌��� �@�@�@�@�@�@�@�H��@�F�@�c�m�`�̂����� |
| �P�O���P�U���i���j�̃t�����e�B�A�N���X�́u�n�M���d�Ƃ́v�Ƃ����e�[�}�Ŋe���A���̂����݁E�����E���E�̌���E���{�ł̎��g�ݓ������|�[�g�ɂ܂Ƃ߂܂����B�_�ސ쌧�͔����E���{�Ȃlj���{�݂���������̂ŁA���d���܂��o�C�i���[���d�i�n������̏��C���g�킸�ɋC�����₷���t�̂������ă^�[�r�����j�Ȃǂ����҂����Ƃ���ł��B ���̂��Ƃc�m�`�̑傫�ȂQ�̓����ł����u�����v���u�^���p�N���̐����v�ɂ��ĕ������f�����g���ĉ�����܂����B |
 |
 |
| �t�@�X�i�[���g���Ăc�m�`�������f��������Ă݂܂����B���������O�ɁA�c�m�`�̓�d�点����c�m�`�փ��J�[�[�i�F�̗ցj�Ƃ����点����قǂ��^���p�N���ɂ���Ĉ�{���ɂȂ�܂��B |
 |
 |
| �����Ăփ��J�[�[�ɂ���ĊJ���ꂽ����z����v���C�}�[�[�Ƃ����y�f�ɂ���q�m�`�v���C�}�[�i�������F�̗ցj���t�����A���̃v���C�}�[���c�m�`�����������c�m�`�|���}���[�[�i�Е��̉���z������ɐV����������������y�f�E���F�̗ցj���Ăэ��݂܂��B ��{�ɕ�����ꂽ��̍��i���[�f�B���O���Ƃ����܂��j�ɂ��Ă͂c�m�`�|���}���[�[�̍��������ƁA�点�قǂ����������v���Ă���̂łփ��J�[�[�i�̗ցj��ǂ�������悤�ɃX���[�Y���c�m�`�i���j�������i�݂܂��B �������A���̍��i���M���O���Ƃ����܂��j�͉���Ȃ����Ă����������̍��Ƌt�ɂȂ��Ă���̂����i�x�[�^�j�N�����v�Ƃ�����̂���ς����i���̗ցj���t���A���^�c�m�`����̍��Ɠ��������ɂȂ�悤�Ɉ������݂܂��B |
 |
 |
| ����Ɖ��̍������[�v��ɂȂ�A��荞�܂��ۂ��c�m�`�i���j����������܂��B�����ă��N�����v���c�m�`�|���}���[�[�i���F�̗ցj���痣���̍��Ɠ��������ɑ���o����܂��B���̂����݂��𖾂����͓̂��{�̉���ߎ����m�ŁA���m�̌��тɂ��Ȃ݃��M���O���̕����Ő�����Z���c�m�`�i�ԁj���u����t���O�����g�v�ƌĂ�ł��܂��B�t���O�����g�ifragment)�Ƃ͒f�ЂƂ����Ӗ��ł��B |
 |
���̐}���c�m�`�փ��J�[�[�̐i�s�����ɉ����ăX���[�Y�ɍ������s���鍶���̍������[�f�B���O���A���[�v�����Ȃ���s�A���ɍ������i�މE���̍������M���O���Ƃ����܂��B �������s���y�f�c�m�`�|���}���[�[�͂T�f���[����R�f���[�̈���������c�m�`�̍���L�����Ƃ��ł��܂���B ���[�f�B���O���ł͖��Ȃ��c�m�`��L�����邱�Ƃ��ł��܂����A���M���O���ł͒��^�c�m�`���|���}���[�[�Ɉ������݁A�T�f���R�f�̌����ɒ����A���[�v�̕������c�m�`���������Ă����܂��B ���������������f�Ђ̂c�m�`���|���}���[�[���痣��A���̒f�Ђ̍����Ɏ�肩����܂��B���̕����̒f�Ђc�m�`���c�m�`���K�[�[�Ƃ����y�f�łȂ����킳��ĂP�{�̂c�m�`���ɂȂ�܂��B |
| ���w�Z�U�N���̂g�N�������ō�����c�m�`�̃N���t�g�������Ă��Č����Ă���܂����B��T�̂h����쐬�̂c�m�`�ƂȂ��Ă݂܂����B |
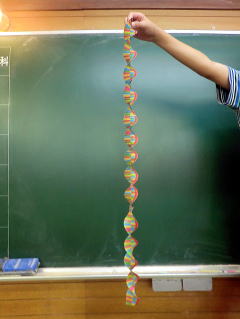
| �����������E�ア�͂��̂c�m�`�̉���z��Ō��܂�܂��B���������ނ��G�^�m�[�����A�Z�g�A���f�q�h�ɂȂ�܂����A������_�������|�_�i��������j�ɕς��A����ɖ��Q�ȓ�_���Y�f�Ɛ��ɂ��Ă����y�f������܂��B ���̍y�f���A���f�q�h�E���y�f�Ƃ����܂����A���̊������ア���A�Z�g�A���f�q�h�����܂��������ꂸ�̓��ɒ����Ԏc��A�C���������Ȃ�����A��ʂɈ��������ꍇ�͑�ςȂ��ƂɂȂ肩�˂܂���B �A���f�q�h�E���y�f�̊������ア�̂́A������R�[�h�i�w��j���Ă����`�q�̕������P�ӏ����������ɋ����l�ƈقȂ��Ă��邩��Ȃ̂ł��B�c�m�`����A���f�q�h�E���y�f���R�[�h����̈�ɂ��W�O�O�ȏ��̉������ł��܂����A�قȂ�������̂��������ꕶ�������ł��B ���@�l�ɂ���ĉ���̔z�قȂ�ӏ����r�m�o�i�X�j�b�v�j�[Single Nucleotide Polymorphism�[�Ƃ��ł��܂��B�P�̉���ψق��đ��l���������Ă����ԂŁA�u�ꉖ��^�v�Ƃ������܂��B���݂킩���Ă��邾���ł��A�q�g�Q�m����̂r�m�o���R�O���̉���̒��ɂP�P�O�O���J���ȏ゠��A���̂����^���p�N�����R�[�h����̈�ɂ�����̂͂U�T�Q�O�R�J���ŁA�q�g�ł���R�O�O�J���ɂP�J������u��������Ă���Ƃ��낪����܂��B ���������l�A�E���ア�l���A���f�q�h�E���y�f������z��i��`�Í��j�̈ꕔ���ł��B�������Ⴄ�ł��傤���H |
| agagagagag�@ aggcacccgg�@ cagccattac�@ �@agagagagag �@aggcacccgg�@ cagccattac tcgtcctcac �@ tcccacacca �@acaacctcca�@�@�@ tcgtcctcac�@ tcccacacca�@ acaacctcca tccagtgcct �@ gccgaagccg �@cttctgctgc�@�@�@�@tccagtgcct �@gccaaagccg �@cttctgctgc agcggggacg �@cgtgcaagta�@ caggaggata�@�@ agcggggacg �@cgtgcaagta�@ caggaggata tccgcttcca �@ ttactgcgct �@gcgccgcggc�@�@�@ tccgcttcca �@ttactgcgct �@ gcgccgcggc ggaaacagca�@gcagcagagg�@ ggttcttcga�@�@ �@ggaaacagca �@gcagcagagg �@ggttcttcga ttcggggggt �@tcggccggcg�@�@ggcgcaataa�@�@�@ttcggggggt �@tcggccggcg�@�@ggcgcaataa attttgcccg �@ggatggctcg�@ gagggccgcg �@�@�@ attttgcccg �@ggatggctcg �@ gagggccgcg tcctcgctcg�@tctcccgctg �@ cctcttggcc�@�@�@�@�@tcctcgctcg�@tctcccgctg�@ �@cctcttggcc agggcctctg�@ cccccgccgc�@gccacccgct�@�@ �@agggcctctg�@ cccccgccgc �@gccacccgct |
| �@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�����@ ������Q��ڂ̏ォ��R�i�ڂ̃O���[�v�����Ă��������B������S�߂��A�����l�ł�"g"�ŁA�ア�l�ł�"a"�ɂȂ��Ă��܂��B ����R�g�ɂȂ��ăA�~�m�_���w�肵�Ă��܂����A"gaa"���O���^�~���_�������Ă��܂����A"aaa"�����V���Ƃ����A�~�m�_���w�肵�Ă��܂��A����ɂ���đ�ӊ������キ�Ȃ��Ă��܂��̂ł��B �@�@�@�@�@�@�@�@�@���Ă��Ȃ��͂ǂ���̃^�C�v�ł��傤���H |